Lösungen Kapitel 15
From BioPhy.de Wiki
Aufgabe 15.1:
Messung der Kapazität von Membranen mittels Fleckenklammer (patch clamp-)-Technik.
Zur Untersuchungen der Endozytose und Exozytose benutzt man heute oft Fluoreszenzmethoden. Schonender und physikalisch interessanter sind Messungen der Kapazität der Zellhülle mit der Fleckenklammertechnik. Dies gilt insbesondere dann, wenn die Exozytose durch Erhöhung des intrazellulären Ca-Spiegels induziert wird. Ein wichtiges Beispiel sind die Chromaffin Zellen. Sie dienen der Erzeugung und Ausschüttung von Adrenalin (ein Epinephrin) und Noradrenalin. Sie entstehen während der embyonalen Entwicklung aus der Neuralleiste (dem Urzustand des Nervenssystems)und sind daher eng mit Nervenzellen verwandt. Die Zellen sind in den Nebennieren lokalisiert. Diese Organellen sind ein Teil des vegetativen Nervensystems und sind zufällig über den Nieren platziert, was ihnen den eigenartigen Namen gab. Die Ausschüttung des Adrenlins in das Blut wird durch Depolatisation der Zellmembran induziert. Diese wird durch Nervensignale nach Stress ausgelöst. Man kann daran besonders die Ca-induzierte Sekretion studieren.

Messung der Kapazität: Die Messung erfolgt unter der Bedingung der Spannungsklammer. Da man sehr kleine Änderung der Ströme messen muss, wird die Methode der phasenempfindlichen Gleichrichtung (mit Lock-in-Verstärker) angewendet. Die Zelle wird mit einer sinusförmigen Spannung angeregt und man misst die induzierten Änderungen des Stroms. Ist die Frequenz der Anregung hoch, so ist die gemessene Änderung des Stromes proportional zur Membrankapazität und damit ein Maß für die Änderung der Membrankapazität.
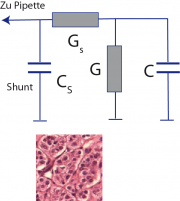
Der gesamte komplexe Widerstand des Ersatzschaltbildes ist . Eine leichte Umrechnung liefert für den komplexen Widerstand R* und die Leitfähigkeit:
mit
Zur Beantwortung der Zusatzfrage betrachten wir die Änderung des komplexen Widerstands mit der Leitfähigkeit G der Kanäle und der Membrankapazität. Man erhält:
und
Die Änderung des komplexen Widerstands mit der Membrankapazität nimmt mit der Frequenz zu, während die mit der Leitfähigkeit abnimmt. Die Empfindlichkeit der Messung der Membrankapazität wird mit zunehmender Frequenz also immer größer.
Ein wichtiges Ergebnis des Experiments von Neher und Marty: Durch Variation des intrazellulären Ca-Spiegels wurde gezeigt, dass die Exozytose der Hormone durch Ca-Ausstoß in der Zelle ausgelöst wird, und dass es eine Untergrenze des intrazellulären Ca-Spiegels von 10 nM gibt, unterhalb der keine Exozytose mehr erfolgt. Aus der Änderung der Kapazität lässt sich die Größe der Vesikel abschätzen.
Aufgabe 15.2:
Über den Bau von Biosensoren-Impedanzspekroskopie und Nanovoltmeter.
Das Lernziel dieser Aufgabe ist sich mit elektrischen Eigenschaften von hydratisierten Schichtsystemen zu befassen. In Aufgabe 9.2 hatten wir auf die Bedeutung festkörpergestützter Membranen für den Bau von Biosensoren auf elektro-optischen Bauelementen hingewiesen. Dabei kann es sich um Halbleiter auf - oder Gallium/Arsenid-Basis handeln (MOSFET). Aber oft ist es einfacher, mit Indium-Zinnoxid (ITO-)-Halbleitern oder Glas/Gold-Übergängen zu arbeiten, denn es ist extrem schwierig, elektrisch gut isolierende Lipidfilme auf den Halbleitern mit rauen Oberflächen zu deponieren. Man verzichtet dabei auf die Möglichkeit der Miniaturisierung. Man kann drei Arten elektrischer Sensoren aufbauen. Erstens, Membranen, die vom Halbleiter durch einen einige 10 nm dicken Polymerfilm oder Elektrolyt getrennt sind und in die man Enzyme oder Ionenkanäle einbauen kann. Zweitens, direkt auf dem Halbleiter fixierte Membranen zur Messung von Oberflächenladungen (Literatur siehe S. Gritsch et al. Langmuir,14: 3118-3125 (1998)). Eine weitere elegante Möglickeit besteht darin, Membranen über Poren in Festkörpern zu spannen (s. dazu Ch. Danelon, et al. Langmuir, 22 22-25 (2006). Oder N. Fertig et al. Biophys J. 82: 3056-3062 (2002)). In der Aufgabe betrachten wir das erste in folgender Abbildung dargestellte System.

Zu Berechnung der Impedanz des Sensors müssen wir vier Schichten betrachten: Den Halbleiter, den Elektrolyt, die Membran und den Puffer. Jeder Schicht wird durch eine Parallelschaltung eines Widerstandes und einer Kapazität bestimmt, was 8 unabhängigen Variablen entspricht. Man kann diese Zahl jedoch reduzieren, indem man den Halbleiter und die anschließenden Elektrolytfilm zusammenfasst. Die einzelnen Beiträge der drei restlichen Schichten lassen sich durch Messung der komplexen elektrischen Impedanz als Funktion der Frequenz (d.h. durch elektrische Impedanzspektroskopie) bestimmen. Außerdem interessiert für Anwendungen in der Sensorik nur der Beitrag der Membran, z.B. die Leitfähigkeit der Kanäle.
Die Impedanz: Man erinnere sich daran, dass die Leitfähigkeit G* und die komplexe Impedanz Z* eine Parallelschaltung aus Widerstand und Kapazität
gegeben sind durch:
und
(1)
Die gesamte Impedanz des schichtartig aufgebauten Sensors ist dann:
Man kann die nackte Impedanz der Halbleiter-Oberfläche ES durch eine Kapazität und einen Widerstand
(den Faraday-Widerstand der Elektrolyt-Elektroden-Grenzfläche) charakterisieren. Diese Parameter bestimmt man durch Anpassung von
an die beobachtete Kurve.
In Gegenwart der Membran verschiebt sich das Spektrum leicht zu hohen Frequenzen und es entsteht eine Schulter, deren Höhe den Wert der Kapazität und des Widerstands
der Membran liefert. Baut man Gramicidin-Poren ein, so erniedrigt sich der Widerstand, falls der Elektrolyt aus Puffer mit Na und organischen Anionen (Na-Hepes Puffer) besteht. Wird dieser durch Cl-Trispuffer ersezt, so ändert sich das Impedanzspektrum wie erwartet kaum, da wir in Kapitel 12.7 lernten, dass Gramicidin selektiv
oder
leitet.
Bemerkungen zur Qualität der Sensoren auf ITO-Halbleitern.
Der Widerstand der Membran bestimmt die Empfindlichkeit des Sensors. Die höchsten
-Werte (
) erhält man mit Phospholipid-Cholesterol Mischungen [Gritsch et al 1998)]. Damit lassen sich rund 1000 Poren pro
nachweisen.
Der Widerstand der 'Schwarzen Membranen' (Kapitel 12.7) ist mit hundert mal größer. Der niedrigere Grenzwert ist durch die Leitfähigkeit der Wasserfilms zwischen Membran und dem Halbleiter (oft Mantelwiderstand genannt) bestimmt.
Anwendung der Impedanzspektroskopie in der Zellbiophysik: Diese wird insbesondere zur Messung der Dichtigkeit und Permeabilität von konfluenten Endothelzellschichten (z.B. der Blut-Gehirnschranke) eingesetzt. Ein Beispiel ist Messung der Bildung von Passagen durch dichte Endothelzellschichten durch die Protease Thrombin oder das Hormon Histamin, die dazu dienen, die Migration von Blutzellen durch die Adern zu erleichtern (s. Kapitel 28.1; Referenzen: Steinem et al. Biochim. Biophys. Acta 1279: 169,(1996); Hillebrandt et al. Appl. Phys. A73, 539-546 (2001)).
Aufgabe 15.3:
Eine Kurze Begründung der Hill-Gleichung kooperativer Prozesse.
Die 100 Jahre alte Hill-Gleichung gehört zu den wichtigsten Grundlagen der Biochemie. Sie wird oft benutzt, um die Zahl der Liganden zu bestimmen, die an ein Enzym binden müssen, um dieses zu aktivieren und zwar dann, wenn die Enzymaktivität als Funktion der Konzentration der Liganden einen s-förmigen Verlauf aufweist. Man darf jedoch nicht vergessen, dass sie nur gilt, wenn die Bindung streng kooperativ ist und keine metastabilen aktivierten Zwischenzustände auftreten. Es muss sich also um Alles-oder-Nichts-Prozesse handeln.
Im Fall der Öffnung der Ionenkanäle R (beispielsweise der pentamere Acetylcholinrezeptor) durch Bindung von Liganden L (d.h. von Acetylcholin) haben wir es mit folgendem Gleichgewicht zu tun: . Die Dissoziationskonstante sei
, wobei
. Der Bruchteil der besetzten Bindungsstellen (oder aktivierten Monomere des Komplexes) ist dann:
Die beiden Modelle der kooperativen Umwandlung nach Kittel-Changeux (in 15A) und Hill liefern beide s-förmige Bindungskurven. Allerdings kann das chemische Hill-Modell keine Phasenumwandlungen erster Ordnung beschreiben, wie das physikalische Kittel-Changeux Modell.