Lösungen Kapitel 9
From BioPhy.de Wiki
Contents |
Aufgabe 9.1:
a) Bildung von Kohlensäure: Der durch das Blut transportierte Sauerstoff wird im Muskel durch Austausch zwischen Blutkapillaren und Muskelzellen abgegeben. Er dient dort zur ATP-Erzeugung durch den aeoroben Metabolismus in den Mitochondrien.
Dort laufen zwei Prozesse ab: Der Zitratsäure-Zyklus (auch Krebszyklus genannt) und die oxidative Phosphorylierung in der Elektronen-Transferkette (= Atmungskette).
Zellen produzieren CO im Krebszyklus der zu dem Ausgangsprodukt der Elektronen-Transfer-Kette Pyruvat führt, und zwar nach der folgenden pauschalen Reaktion:
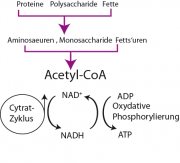
Zur Erinnerung: Im oxidativen Metabolismus wird ATP durch 'kalte Verbrennung' der Nahrungsmittel erzeugt. Diese werden zuerst in kleinere Moleküle abgebaut, ein Katabolismus genannter Prozess. Dabei entsteht das Co-Enzym Acetyl (CoA). Dieses wird im Citratzyklus weiterverarbeitet, der wie die oxidative Phosphorylierung (Atmungskette) in den Mitochondrien stattfindet. Das wichtigste Endprodukt des Citratzyklus ist das NADH, welches als protonenreiches Ausgangsprodukt der oxydativen Phosphorylierung dient.
Man kann den Prozess durch das folgende Schema charakterisieren.
Der Zitratzyklus kann als der dritte von vier Schritten im Kohlenhydrat-Katabolismus betrachtet werden. Er findet nach der Glykolyse und der oxidativen Decarboxylierung von Pyruvat zu Acetyl-CoA, jedoch vor der Endoxidation in der Atmungskette, statt.
Weitere Information:
In den Erythrozyten wird CO zu Kohlensäure hydratisiert.
Diese dissoziiert in H und HCO
, das Bikarbonat (oder oft Hydrogen-Bicarbonat) genannt wird. Letztere wirkt als Base. Das Kohlensäure-Bicarbonat-Paar spielt eine wichtige Rolle zur Pufferung des Blutes. Wenn dieses nicht sauer genug ist, dissoziiert Kohlensäure und setzt Protonen frei.
Unter normalen Bedingungen binden die Protonen an Hämoglobin, während das Bicarbonat im Austausch gegen Chlorionen in das Blut-Plasma geht.
b) Giftigkeit von CO: Wir betrachten die chemischen Gleichgewichte
und
Dabei sind [CO] und [O] die Konzentrationen der Gase im Blut. Die Aufnahme eines Gases aus Luft durch Zellen oder Hämoglobin im Blut hängt vom Löslichkeitskoeffizient ab. Es gilt das Henry-Dalton Gesetz. Nach diesem ist die Konzentration des Gases in der Lösung proportional zum Partialdruck (siehe Schmitt et al. Physiologie des Menschen, Kapitel 27.2):
(1)
wobei [Gas] die Konzentration des Gases in der Lösung und der Partialdruck des Gases X ist.
ist der Löslichkeitskoeffizient der Gase. Die Zahl 760 steht im Nenner, weil p in Atmosphären angegeben wird.
hat die Dimension [
]=
. Dabei wird der Druck gemessen in mm Hg:
Erinnerung: 1 mm Hg = 133.3 Pa. 1atm 10.1 Pa
Für die Abschätzung benutzen wir die bekannten Werte der Löslichkeiten in Wasser:
, 37° C: in Blut:
=0.028 in Wasser
= 0.02
,37° C: in Blut:
=0.49 in Wasser
= 0.57
, 37° C: in Blut:
=0.012 in Wasser
= 0.012
, 37° C: in Wasser
0.03
Die gesetzlich festgelegte Konzentration des CO in der Luft am Arbeitsplatz ist 0.003 Volumprozent. Bei 0.1 Volumprozent CO in Luft sind 50 % des Hämoglobins mit CO besetzt. Aus der Bindungskurve des folgt, dass 50%des Hb bei einem Partialdruck von
23 mm Hg besetzt sind. Daher ist das Verhältnis der Partialdrücke
.
Man muss nun noch Folgendes berücksichtigen: Die Löslichkeiten der Gase in Wasser (oder Blut) verhalten sich nach obiger Tabelle wie , d.h.
ist schlechter löslich. Wir müssen daher den Partialdruck des Sauerstoffes um den Faktor
erhöhen, um die Gleichgewichte in Lösung zu vergleichen. Daher daher müssen sich die Konzentrationen in Wasser (oder im Blut) wie
verhalten, um 50% des Hämoglobins zu besetzen. Aus diesem Grund ist das Verhältnis der Bindungskonstanten wie
.
Aufgabe 9.2:
Die Gaschromatographie ist (wie die Hochdruck-Flüssigkeitschromatographie) eine Methode der Verteilungschromatographie. Sie erfordert die zerstörungsfreie Verdampfung der Substanzen, die durch einen Gasstrom (des Trägergases wie Helium) aufgenommen werden. Dieser wird durch ein bis zu 200 m langes mäanderförmig gebogenes Rohr (Innendurchmesser 0.1 bis 0.5 mm) geleitet. Dieses besteht aus Metall oder Quarzglas, welches sich in einem Thermostaten befindet. Die Trennung der Moleküle beruht auf der unterschiedlichen Adsorption der Moleküle auf Festkörperoberflächen, die vom Dampfdruck, von der Polarität oder der elektrischen Ladung der Moleküle abhängt. Treibt man ein Gemisch von Molekülen durch das Rohr, so kommen diese zu verschiedenen Zeiten am Ende wieder heraus. Man kann die Moleküle durch Gasdetektoren in zeitlicher Folge beobachten.
Um die Art der Moleküle zu unterscheiden, geht man in der Regel empirisch vor. Jede Molekülsorte benötigt eine feste Zeit (die Retentionszeit), um das Trennrohr zu durchlaufen. Man eicht also die Säulen mit verschiedenen Substanzen, unter denen möglichst auch diejenige ist, die man nachweisen möchte. Häufig kennt man diese, wie z.B. beim Nachweis von Rauschgiften.
Man kann auch bekannte Regeln ausnutzen, wie das Raoultsche Gesetz. Dieses besagt: Je höher der Partialdampfdruck einer Substanz, umso länger hält sich die diese in der Gasphase auf, d. h. umso kürzer wird die Retentionszeit.
Aufgabe 9.3:
Glykoproteine entstehen durch Ankopplung von Zuckermolekülen an Seitengruppen von Aminosäuren und Glykosilierung erfolgt gewöhnlich post-translational. Zuckermoleküle (wie einzelne Zuckermoleküle, Di-Saccharide und Oligosaccharide) werden bevorzugt an Asparagin-, Serin-, Threonin- oder Hydroxylysin-Reste der Aminossäuren gebunden.
O-Glykosilierung: Kopplung der Zuckerreste an Hydroxylgruppen von Serin, oder Threonin. Diese Kopplung erfolgt im Golgi-Apparat in einem mehrstufigen Prozess, wobei spezifische Enzyme die Glykosyl-Transferasen beteiligt sind. In jedem der Fraktionen findet ein anderer Prozess statt. Von Proteinen, die in Membranen eingebaut oder exportiert werden sollen, werden im cis-Golgi zwei Mannosereste entfernt. Die Glykoproteine, die für Lysosomen bestimmt sind, werden weiter modifiziert, indem im mittleren Golgi zwei weitere Mannosereste entfernt werden, und N-Acetylglucosamin und Fucosereste angedockt werden. Schließlich können im trans-Golgi weiter N-Acetylglucosamin-Reste angefügt werden. Die Modifikation im Golgi konditioniert also die Glycoproteine für ihre spezifischen Aufgaben.
In diesem Zusammenhang sollte der interessierte Leser im Kapitel 9 die Rolle des Zuckerrests Mannose 6-Phosphat als Marker zum Transport der nur in sauerem Medium aktiven Enzyme in die Lysosomen betrachten.
N-Glykosilierung: N-glykosidische Bindung Hier erfolgt die Bindung des Zuckers an den Stickstoff der freien Säureamid-Gruppe von Asparagin. Die N-Glykosylierung erfolgt im endoplasmatischen Retikulum (ER). Normalerweie wird der Zucker separat synthetisiert und über das lipidartige Molekül Dolichol an die, in das Lumen des ER zeigende, Peptidsequenz angedockt. Der Prozess ist in Abb. 9.9 dargestellt. Details findet man in der Monographie Berg et al. Biochemie 5. Auflage Ch 11.32. Die Proteine werden dann im Golgi-Apparat weiter modifiziert.
Aufgabe 9.4:
Vorbemerkung: Die Konzentrationen der Hormone im Körper sind sehr verschieden. Besonders niedrig sind die Werte für Insulin (1.4 10) und Hämatopoetin (10
M), das Hormon, das die Produktion von Erythrozyten steuern. Wesentlich höher sind die Konzentrationen der Epinephrine (wie Adrenalin), die bei
M liegen.
Aus dem Verlauf der Bindungskurven der Hormone an Rezeptoren folgt: Um maximale Empfindlichkeit eines Hormons möglichst hoch einzustellen, muss die Konzentration der Hormone wesentlich kleiner sein als , damit man im steil ansteigenden Bereich der Bindungskurven ist. Bei [I]
1,4
M sind 50% der Rezeptoren besetzt. Bei einer Erhöhung von [I] um einen Faktor 5 würde der Besetzungsgrad
nur auf 66 % steigen. Da die Empfindlichkeit der Hormonwirkung umso größer ist, je stärker die Änderung des Besetzungsgrades mit der Hormonkonzentration ist, nimmt diese mit dem Besetzungsgrad
ab. Eine genauere Betrachtung der Optimierung der Empfindlichkeit durch Anpssung der Rezeptordichte auf den Zellen findet man im Kapitel 9.10. des Buches.
Zur Lösung der Aufgabe betrachtet man das Bindungs-Gleichgewicht zwischen Rezeptor (R) und Ligand (I oder A). Die Dissoziationskonstante sei und der Bruchteil gebundener Liganden
.
Bei gleicher Besetzung von Rezeptor und Agonist gilt . Daraus folgt:
Daraus folgt, dass die Konzentration des Agonisten sehr viel höher sein muss, als die des Hormons um Nebenwirkungen zu zeigen.
Nebenwirkungen können aber auch hohe Konzentrationen natürliche Antagonisten des Insulinrezeptors bewirken. Beispiele sind Wachstumsfaktoren (z.B. IGF-1) Diese haben aber auch sehr viele größere Bindungskonstanten ().
Weitere Information findet man im Kapitel 9.10 und im Ch. 15 der Monographie von Lodish et al. Molecular Cell Biology.
Aufgabe 9.5:
Zusammenstellung der Ionenkonzentrationen:
Erythrozyten: Außenraum [K] = 10mM, [Na] = 140mM Zytoplasma [K] = 150mM, [Na] = 14 mM
Nervenzellen: Außenraum [K] = 20mM, [Na] = 440mM Zytoplasma [K] = 400mM, [Na] = 50mM
Für den Fall der Erythrozyten gilt:
Da pro Elementarakt 3 und 2
-Ionen transportiert werden, wären etwa 36
zur Aufrechterhaltung des obigen stationären Gleichgewichtes notwendig. Die pro ATP frei werdende freie Energie
liegt unter den üblichen physiologischen Bedingungen der Zelle bei -50
[Berg et al Biochemie].
Da nur eine Überschussladung (das dritte Na-Ion) entgegen dem elektrischen Feld verschoben werden muss, sind zusätzlich -6 meV notwendig, um gegen das elektrische Potential Arbeit zu leisten. Dies sind 0.6 .
Für den Fall der Nerven:
Insgesamt sind für die Arbeit gegen den Konzentrationsgradienten 32 notwendig. Da 50 kJ verfügbar sind, würde die ATP Spaltung ausreichen, um gegen eine Spannung von 190 mV (entsprechend 18
) zu arbeiten.
Merke: Bei der Abschätzung ist die Faustformel hilfreich, dass oder 2.4
ist.
Aufgabe 9.6:
Man betrachte dazu auch Abb. 9.15. Zum Problem der Farbwahrnehmung siehe auch: Schmidt. Physiologie des Menschen. Kapitel 16. [2] Nicholls et al 'From Neuron to Brain' Kapitel 19.
Frage 1:
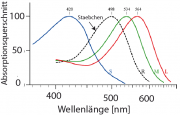
Young und Helmholtz postulierten (lange vor der Entdeckung der Zellen) in ihrer Dreifarben-Theorie als erste, dass das Farbsehen auf der Überlagerung der Signale aus drei Arten von Rezeptoren besteht. Erst viel später (1964) entdeckte G. Wald, dass es sich bei den Rezeptoren um Zapfenzellen (Zapfen) und Stäbchenzellen (Stäbchen) handelt. Das menschliche Auge enthält drei Arten von Zapfen, die bei 420, 534 und 564 nm maximal absorbieren. Wie im Kapitel 9 gezeigt wurde, liegt das Maximum der Absorption des Rhodopsins der Stabzellen bei 498 nm (s. Abb.).
Das menschliche Auge besitzt etwa 120 Millionen Stäbchen und 6 Millionen Zapfen. Die beiden Zellarten sind in der Netzhaut unterschiedlich verteilt. Die Zapfendichte ist besonders hoch (etwa 2000 000 /) in der sogenannten Fovea, einem Bereich der Netzhaut, in dem das Licht nicht durch die Bündel von Nervenleitern abgeschwächt wird. Die Stabzellen sind dagegen aus diesem Bereich ausgeschlossen.
Da die Rezeptoren der Zapfen sehr viel weniger empfindlich sind, als die der Stäbchen, kann man Farben nur im Tageslicht sehen. Die Zapfen besitzen auch nicht die enorme Fähigkeit zur Dunkeladaption, wie die Stäbchen.
Frage 2:
Die relative Zahl der Zelltypen bestimmt auch ob Tiere tag- oder nachtblind sind. Katzen besitzen sehr wenige Zapfen (etwa 1.6 % der Sehzellen) während beim Menschen der Prozentsatz bei 20 % liegt. Das Farbsehen der Katzen ist also stark eingechränkt. Sie sind aber nicht farbenblind (wie 0.01 % der Menschen). Andere Tiere wiederum übertreffen den Menschen beim Farbsehen. So haben viele Vögel noch Zapfen, deren Absorptionsmaximum im UV liegt (ca. 420 nm). Sie können daher mehrere blaue Farben unterscheiden, wo wir nur einen Farbton wahrnehmen.
Wer sich für die Verarbeitung der Farbinformation im Gehirn interessiert sollte sich in dem Buch von Nicholls et al. beginnen.
Aufgabe 9.7:
Ca- Freisetzung, Ca-Wellen und Ca-Verteilung in Zellen.
a) Bildung des Botenmoleküls IP3
Vorbemerkung: IP3 ist ein Botenmolekül mit verschiedenen Aufgaben. Die wichtigste ist die Öffnung der Ca-Speichervesikel (das ER und Sarkoplasmatisches Retikulum) durch Bindung an spezifische Ca- Kanäle, die dadurch geöffnet werden. Freigesetztes Ca bindet seinerseits an den Rezeptor und induziert dessen Öffnung. Durch diese positive Rückkopplung wird der Ca-Ausfluss lawinenartig verstärkt. Zur Rückstellung des Ca- Spiegels auf den ursprünglichen Wert (), wird IP3 durch Phosphatasen abgebaut und Ca wird aus der Zelle gepumpt.
Die positive Rückkopplung des Ca auf die Kanäle kann zur Ausbildung von zeitlichen Folgen aus impulsartigen Ca-Wellen führen, die sich über das Zytoplasma ausbreiten. Solche Wellen werden durch Hormone ausgelöst und der zeitliche Abstand der Ca-Impulse nimmt mit der Hormonkonzentration ab. Die Perioden sind von der Größenordnung Minute (s. Alberts et al Ch 15). Die Impulsfolge wird während der ganzen Zeit der Bindung der Hormone an die Zelle aufrechterhalten. Die Funktion der Ca-Wellen ist unklar. Möglicherweise dienen sie dazu, Hormonsignale zu verstärken, ohne dass der Ca-Spiegel ständig über dem Ruhewert liegen muss.
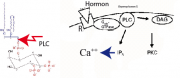
IP3-Erzeugung: IP3 wird durch Abspaltung der Kopfgruppen von Inositioldiphosphaten (z.B. PI-4,5-P2) durch Phospholipase C erzeugt, nach dem im folgenden Bild (rechts) gezeigten Schema. Dabei entsteht gleichzeitig ein zweites Botenmolekül Diacylglycerol (DAG). Dieses aktiviert die Proteinkinase C (wobei C anzeigt, dass die Kinase nur in Anwesenheit von Ca arbeitet).
Aktivierung der Phospholipase C: Hier sind zwei Wege. Der häufigste ist die Aktivierung der heterogenen GTPase , (die wir bei der Besprechung der Hormonverstärker diskutierten) und der im rechten Bild unten gezeigt wird. Der zweite Weg erfolgt über die Klasse der Rezeptor-Tyrosin-Kinasen, (siehe Kapitel 9 Anhang):
\end{figure}
b) Intrazelluläre Lokalisierung des Ca
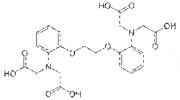
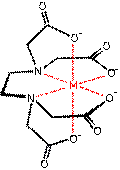
Die derzeit wichtigsten Methoden basieren auf der Verwendung von Farbstoffsonden, die mit Ca- Ionen Komplexe (Chelate genannt) bilden. Ein besonders starker Komplexbildner ist BAPTA. Durch chemische Modifikation werden fluoreszierende Chromophore gebildet (wie Fura-2), deren Fluoreszenzquantenausbeute von der Ca-Bindung abhängt. Das folgende Bild zeigt die Bildung der Chelate durch Ausbildung von Koordinationsbindungen zwischen O und N-Gruppen.
Aequorin ist ein anderer wichtiger Ca-Indikator, da er in Gegenwart von Ca selbst leuchtend ist. Aequorin ist ein Protein aus Leuchtquallen. Im Protein ist ein Luziferin-Molekül eingelagert, das nach Zugabe von Lichtquanten von = 470 nm emittiert. Es heißt auch 'blau-fluoreszierende Protein'.
Das Experimente von Llinas an immunologischen Synapsen:
Ein schönes und wichtiges Beispiel ist die Beobachtung der spontanen Erhöhung der lokal Ca- Konzentration im Zytoplasma der neuronalen Synapsen. Wie wir im Kapitel 14 sahen, wird die Erregung der postsynaptischen Membran durch Ausschüttung von Transmittern (wie Acetylcholin) in den synaptischen Spalt vermittelt; Und zwar durch Fusion der synaptischen Vesikel mit der präsynaptischen Membran, Die Fusion wird durch Einstrom von Ca-Ionen über die durch einen Spannungsimpuls geöffneten Ca -Kanäle getriggert (siehe dazu auch Aufgabe 14.5).
Ein schönes Experiment zum Beweis diese Hypothese stammt von Llinas et al (Science 256: p 677 (1992)). Dieses wurde an der Synapse des Riesenaxons des Tintenfisches durchgeführt, die größte bekannte neuronale Verbindung (s. Abb b). Sie dient zur Erregung der Muskeln, welche den Wasserstrahl erzeugt, dessen Rückstoß die Tiere vorantreibt (s. Wikipedia Squid Giant Synapse). Es sind dieselben Axone, an denen Huxley und Hodgkin ihre bahnbrechenden Experimente durchführten.
Die aktiven Verbindung zwischen den Axonen wird durch Synapsen vermittelt, deren Struktur nicht sehr genau bekannt ist. Möglicherweise handelt es sich um krallenartige Verzweigungen, wie im Fall der Synapsen an der Muskelendplatte.
Abb. c zeigt die Verteilung der spontanen Fluoreszenz des Chromophoren. Jeder Leuchtfleck entspricht einer Synapse. Abb d zeigt die Ca-Verteilung bei hoher Auflösung, und zwar vor und nach Erregung der präsynaptischen Membran mit elektrischen Impulsfolgen. Man erkennt deutlich ringförmige Anhäufungen des Ions.
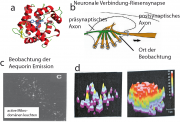
Die Experimente liefern wichtige Informationen. Die mittleren Durchmesser der Domänen sind etwa 0.5 . Die Dichte der Domänen ist etwa
und etwa 10 % der Kontaktfläche zwischen der post-und der prä-synaptischen Membran ist mit Mikrodomänen besetzt. Diese sind stationär durch wiederholte Erregung festgestellt wurde. Die Ca- Konzentration wird während der Erregung auf 250
angehoben.
Ein interessanter Punkt ist die lange Lebensdauer der Ca-reichen Mikrodomänen von rund 200 msec. Sie bestimmen die Refraktärzeit, die durch Entfernung des fusionierten Vesikels notwendig ist (s.Ch 11 in Nicholls 'From Neuron to Brain'). In Aufgabe 10.2 wird gezeigt, dass die lange Lebensdauer durch die Hysterese ladungsinduzierter Konformationsumwandlungen der Membranen bestimmt ist.
Eine wichtige Bemerkung: Im Kapitel 14 haben wir gelernt, dass an den Synapsen des Muskels viele mit Transmitter gefüllte Vesikel beteiligt sind. Dies liegt daran, dass die Acetylcholin-Rezeptor-Domänen der postsynaptischen Membran räumlich sehr ausgedehnt sind und die Dichte der Rezeptoren relativ klein ist (10 000 . Im Falle der sehr kleinen Synapsen im Zentralnervensystem sind die rezeptorreichen Domänen der postsynaptischen Membran sehr klein (\char`\~ 0.5
) und die Dichte der Rezeptoren in viel größer (\char`\~ 70 000 pro
). Daher ist in der Regel nur ein Vesikel an der Signalübertragung beteiligt.