Lösungen Kapitel 34
From BioPhy.de Wiki
Aufgabe 34.1:
Modell der Preston getriebenen Elektromobilität.
Zur Einführung betrachten wir zunächst die Struktur der Zellhülle der OHZ, die (wie im Text erwähnt) eine erstaunliche Ähnlichkeit mit den Schalen der Erythrozyten aufweist. Die Zelle ist jedoch stark polarisiert (mit einem Apexverhältnis von ). Die Aktinfilamente lagern sich im Abstand von etwa 50 nm ringartig (entlang des Umfangs) an der Innenseite der Plasmamembran an, während sie in der Längsrichtung durch Spektrinfilamente (im Abstand von ca. 40 nm) verknüpft sind (s. [2] und [3]). Dieser entspricht etwa der Länge der Spektrin-Monomere (s. Kapitel 9). In der Nähe der Haare sind die Aktinringe um ca 20\
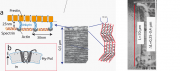
Die Berechnung der Flächenänderung und der Dehnungskraft: Die Flächendichte der Prestinmotoren ist Motoren pro
. Die Fläche pro Motor ist dann
. Die relative Änderung der Fläche aufgrund des Eindringens der
-Helix in die Membran ist
.Mit dem Flächen-Kompressionsmodul
wird ein lateraler Druck von
erzeugt. Damit wird die Kraft pro Zelle mit dem Radius
(mit
).
Zusätzliche Betrachtungen: Typische Längenänderungen L der Zellen bei mechanischen Deformationen sind ([1], s. auch Abb.1 rechts), Die gesamte Fläche der Zellen ist
. Mit 6000 Prestinen pro
wird die Gesamtzahl der Motoren
. Mit
wird die gesamte Flächenänderung
und die Längenänderung bei konstantem Durchmesser
der Zelle
. Dies Ergebnis stimmt mit der Beobachtung recht gut überein. Man kann über die Beziehung
auch eine Kraftkonstante der Zelle definieren. Mit den obigen Werten wird
~
. Nach Ashmore muss
sein.
Referenzen:
1 Holley et al (1992) Structure of the cortical cytoskeleton in mammalian outer hair cells. J cell science 102 56)-580
2 Ashmore J. F. (1987)A fast motile response in guinea-pig outer hair cells: the cellular basis of the cochlear amplifier, Journal of Physiology 388:323-347
3 Wada et al. (2004) Imaging of the cortical cytoskeleton of guinea pig OHZ--Hearing Research 187 51-62
Aufgabe 34.2:
Die dynamische Struktur der Stereocilien.
Zu den größten Wunderwerken der biologischen Evolution gehören die Mechanosensoren des Innenohrs, die man als Weiterentwicklung der Antennen der Insekten betrachten kann. Betrachtet man den komplexen Aufbau der Stereocilien in Abb. 34.5, so ist man besonders überrascht, dass die innere Struktur der Stereocilien ständig erneuert wird. Möglicherweise ist dies notwendig, um die verschiedenen Längen der Reihen von Cilien einzustellen. Die Dynamik wurde in eleganten Experimenten von Rzadzinska et al bewiesen [1].
Die Struktur der Stereocilien wurde in Kapitel 34.5 ausführlich beschrieben und das Bild soll hier etwas erweitert werden:
Die Cilien werden durch Bündel aus 200-300 Aktinfilamenten gebildet, die durch den Bündel bildenden Vernetzer Espin stabilisiert werden. An der Spitze sind die plus-Enden der Aktine mit der Membran verbunden, während die minus-Enden der Bündel einige hundert nm in ein dicht vernetztes Aktin-Gel (die Kutikula oder engl. cuticle) eintauchen.
Die Verbindung mit der Membran an der Spitze kann durch das Motorprotein Myoin XV vermittelt werden. Diese besitzt (wie Talin oder Bande IV) eine FERM-Domäne, mit der es an zytoplasmatische Domänen von Zellrezeptoren (z.B. Cadherine) andocken kann. Ein zweites Motorprotein mit einer FERM Domäne, Myosin VII, wird vor allem im mittleren Bereich der Cilien bobachtet. Die Bindung an die Membran erfolgt durch Kopplung an die zytoplasmatische Domäne eines ZAM der Cadherin-Familie (Cadherin 23), unter Vermittlung des Gerüstpropteins Harmonin. Myosin VII kann so die Cadherine an die Spitze der Cilien transportieren, wo sie z. B. die Bindung zwischen Cilien vermittelt.
Am unteren Ende der Haare werden die Aktinbündel über das Motorprotein Myosin VI an der Membran oder das Aktingel gekoppelt. Myosin VI ist ein Dimeres mit zwei Motorköpfen (s. Abb.1) die zum minus-Ende der Bündel laufen. Es könnte daher z.B. eine rücktreibende Kraft erzeugen, welche die Länge der Cilien limitiert.
Mutationen von Espin verkürzen die Cilien und machen sie weich. Mutationen in MyoXV reduzieren die Länge der Cilien. Mutationen in Myo VI führen zur Verschmelzung der Cilien. Da Myo XV und Myo VI in entgegen gesetzte Richtung laufen erzeugen sie eine Membranspannung.
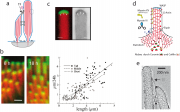
Die Experimente wurden mit Haarzellen von 7 Tage alten Ratten durchgeführt. In einem ersten Schritt wurde Aktin (zur Beobachtung allgemein mit Rhodamin-Phalloidin markiert. Im zweiten Schritt wurde mittels Gen-Transfektion die mit GFP markierte -Isoform von Aktin in der Zelle exprimiert. Wie Abb. 1b zeigt wird die Sonde laufend an der Spitze der Cilien eingebaut. Die Front der grün fluoreszierenden Aktinbündel verbreitert sich und wandert im Verlauf von 48 h nach unten. Die Verteilung des Vernetzers Espin bleibt erhalten. Das Experiment zeigt, dass Aktin ständig an die plus-Enden angedockt wird. Da die Länge der Cilien konstant bleibt, müssen die minus-Enden im gleichen Rhythmus abgebaut werden. Man hat es also mit einem Tretmühlenprozess zu tun, den wir bei der Pseudopodienbildung kennen gelernt haben.
In einem weiteren Experiment wurde auch der Bündelbildner Espin mit GFP markiert, um dessen Einbau zu beobachten. Auch Espin wird laufend an der Spitze eingebaut und wandert mit ähnlicher Geschwindigkeit wie das GFP- -Aktin zur Basis der Cilien.
Abb 1c zeigt ein anderes wichtiges Ergebnis. Die Einbaurate des Aktins ist umso größer, je länger die Cilien sind. Auf diese Weise wird erreicht, dass die unterschiedliche Länge der drei Reihen von Cilien erhalten bleibt, d.h. die Amphitheaterartige Anordnung der Cilien bleibt erhalten). Die schnellste Einbaurate ist 0.04 G-Aktine pro s. Sie ist etwa 100 mal langsamer, als die Einbaurate des Aktins in normalen Filipodien, deren Aktinbündel nur aus 30 Filamenten bestehen.
Zur mechanischen Stabilität der Stereocilien: Wie wir in Kapitel 18.6 sahen, kann durch das Wachstum der Aktinbündel an der Front eine Kraft von 1pN pro Filament erzeugt werden, d.h. insgesamt 300 pN. Der Durchmesser der Cilien ist etwa 200 nm, was einer Membranspannung von entspricht. Diese Spannung kann durch Myo XV verstärkt werden, das an der Spitze angelagert ist, wodurch ein elektronendichter Komplex entsteht, den man im EM beobachten kann (s. Abb 1c). Dieser Komplex spielt für die Kontrolle der Länge der Cilien eine wichtige Rolle. Entfernt man Myo XV, so werden die Cilien sehr kurz und der Komplex an der Spitze verschwindet.
Eine interessante Rolle spielt auch Myosin VII. Es bindet mit seiner FERM-Domäne an die intrazelluläre Segmente von Cadherinen und zwar zusammen mit einem Strukturprotein Harmonin. Daher kann Myo VII die Cadherine in Richtung der Spitze transportieren und die laterale Kopplung zwischen den Cilien über Cadherine vermitteln. Wie wir in Kapitel 34 sahen, sind diese Verbindungen für die Öffnung der Ca-Kanäle aufgrund der Verbiegung der Härchen zuständig.
Eine wichtige Frage ist auch: Wozu dient die ständige Erneuerung der Cilien? Es hat sich gezeigt, dass starke Schallpegel zu Brüchen in den Aktinbündeln führen können, die jedoch langsam (im Verlauf von Tagen) wieder ausheilen. Die Experimente von Rzadzinska et al. zeigen, dass die Cilien von der Spitze her wieder vollständig erneuert werden.
Zur Transfektion der Zellen: Darunter versteht man den Transfer von fremder DNA in Zellen. Wir hatten im Kapitel 36.2 schon darauf hingewiesen, dass man die DNA über Partikel aus positiv geladenen Lipiden oder Polymere in die Zelle schleusen kann. Im Fall der Experiment mit Haarzellen wurde die DNA auf Goldpartikel deponiert.
Harmonin ist ein in fast allen Zellen vorkommendes Gerüstprotein. Es vermittelt die Bindung von Proteinen an die intrazelliuläre Domäne von Adhäsionsmolekülen, wie Cadherin in Sinneszellen [3]. Im Fall der Haarzellen vermittelt Harmonin die Verbindung zwischen Myosin VII und Cadherin. Schließlich kann die zytoplasmatische Domäne und Harmonin auch über das Phosphoinositide PI-4,5-P2 an die Membran binden.
Referenzen:
1 Rzadzinska, AK, et a1. (2004) An actin molecular treadmill and myosins maintain stereocilia functional architecture and self-renewal, Journal of Cell Biology, 164: 887-897
2 Wei Feng Unique features of myosin VI: a structural view. Frontiers in Biology 5: 204-210
3 Hoos, S. et al. (2010) Cadherin-23, myosin VIIa and harmonin, encoded by Usher syndrome type I genes, form a ternary complex and interact with membrane phospholipids. Human Molecular Genetics, 1-9
